| Wärmelehre |
W-Bewegung W-Ausbreitung W-Ausdehnung W-Kapazität Phasenübergänge
Zum Seitenanfang
Wärmeausbreitung |
|
Wärmeenergie kann sich auf drei Arten ausbreiten:
|
Zum Seitenanfang
Wärmeausdehnung |
|

|
Fast alle Stoffe dehnen sich bei Erwärmung aus. (D.h. ihr Volumen nimmt zu.) Der "Wärmeausdehnungskoeffizient" gibt an, um wieviel Millimeter sich ein Stab der Länge 1 Meter bei Erwärmung um 1 Grad verlängert. Die Kräfte, die bei der Wärmeausdehnung auftreten, sind sehr groß. |

|
Mit dem "Dilatometer" können wir die Längenausdehnung verschiedener Stoffe messen. Wir messen z.B., dass sich ein Eisenstab der Länge 0,5m bei Erwärmung von 20°C auf 100°C um 0,48mm verlängert. Aus dieser Messung lässt sich der Wärmeausdehnungskoeffizient berechnen: Wäre der Eisenstab 1m lang gewesen, dann wäre seine Verlängerung 2·0,48mm gewesen, also 0,96mm. Wäre dann dieser (1m lange) Eisenstab nicht um 80 Grad sondern nur um 1 Grad erwärmt worden, wäre seine Verlängerung auch nur 0,96mm/80 gewesen, also 0,012mm. |
|
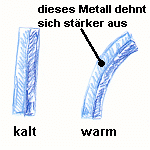
Walzt man zwei Metalle mit unterschiedlicher Wärmeausdehnung aufeinander, erhält man ein "Bimetall". Wird ein Bimetall erwärmt, dann verbiegt es sich. Mit einem Bimetall können Thermometer und Thermostaten aufgebaut werden. |
| Die Wärmeausdehnung von Gasen ist Grundlage für unsere Benzin- und Dieselmotoren, für Düsentriebwerke und Raketenantriebe und auch für den Stirlingmotor. |
Zum Seitenanfang
Wärmekapazität |
|
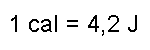
|
Die spezifische Wärmekapazität eines Stoffs gibt an, wieviel Energie (J) nötig ist, um 1g um 1Grad zu erwärmen. Bei Wasser ist dieser Wert ca. 4,2.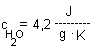 Sollen also 500g Wasser von 20°C auf 70°C (Differenz also 50K) erwärmt werden, ist dazu die Energie E = 4,2 · 500 · 50 (J) = 105000 J = 105 kJ nötig. |

|
Wenn ein Bunsenbrenner in 3,5min 200g Wasser von 20°C auf 80°C erwärmen kann, dann kann man seine Wärmeleistung (=Energieabgabe pro Sekunde) berechnen. 1.Schritt: 200g Wasser um 60K zu erwärmen erfordert die Energie: E = 4,2 · 200 · 60 (J) = 50400 J 2.Schritt: Diese Energie wurde in 3,5min = 210sec abgegeben. Pro Sekunde wurden somit 50400/210 = 240 Joule abgegeben. Die Leistung ist also 240W (Watt). ->Spezifische Wärme von Öl messen |
Zum Seitenanfang
Phasenübergänge |
|
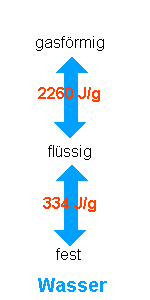
|
|

|
Messen der Verdampfungsenergie von Wasser: Es wird eine beliebige Menge Wasser (z.B. 200 g) erwärmt. Während des Erwärmens wird die Wärmeleistung des Brenners ermittelt, z.B. wie lange es dauert bis das Wasser von 30°C auf 80°C erwärmt wurde.(Z.B. 145 sec) Dann läßt man das Wasser eine bestimmte Zeit sieden, z.B. stoppt man ab Siedebeginn 5 Minuten ab. Dann schaltet man den Brenner ab und mißt, wieviel Wasser verdampft wurde (Z.B. 40 g). Die Auswertung geht folgendermaßen: Während des Erwärmens (von 30°C auf 80°C) wurde folgende Energie zugeführt: E = 4,2 · 200 · 50 (J) = 42000 J Der Brenner benötigte dazu 145 sec, somit ist seine Energieabgabe pro Sekunde: P = 42000 J / 145 s = 290 W Das Wasser hat 5 min = 300 sec gesiedet, in dieser Zeit hat der Brenner also folgende Energie an das Wasser abgegeben: E = 290 W · 300 sec = 87000 J Mit dieser Energie wurden 40 g Wasser verdampft, pro Gramm ist somit folgende Energie nötig: 87000 J / 40 g = 2175 J/g Der Tabellenwert liegt bei 2260 J/g. ->Kühlschrank, Wärmepumpe |